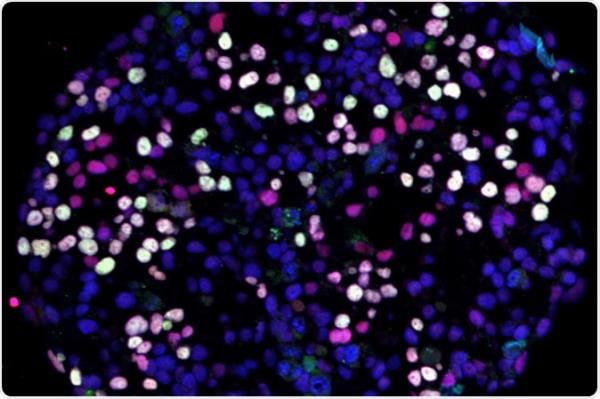
一种控制人类胚胎发育的蛋白质西北大学的研究人员发现,神经干细胞(hESCs)还能抑制恶性黑色素瘤(最致命的皮肤癌)的生长和扩散。
转移性黑色素瘤是由皮肤色素细胞或黑色素细胞转化而来的,死亡率超过80%,中位生存期不到7.5个月。
由医学博士玛丽·j·c·亨德里克斯(Mary J. C. Hendrix)领导的西北大学的科学家们还发现,这种名为Lefty的蛋白质可以防止侵袭性乳腺癌细胞转移。2007年,转移性乳腺癌的死亡人数超过4万人,美国新确诊病例超过18万例。
重要的是,Lefty只在hESCs中分泌,而不是在任何其他类型的干细胞(包括从羊水、脐带血或成人骨髓中分离的干细胞)或胎盘细胞中分泌。
这项研究的结果发表在3月3日的《美国国家科学院院刊》网络版的一篇文章中,该研究建立在亨德里克斯实验室的一项优雅的研究基础上,旨在确定与癌症转移有关的基因和细胞途径。
Hendrix博士是儿童纪念研究中心的主席和科学主任,也是西北大学Robert H. Lurie综合癌症中心和Feinberg医学院的教授。Lynne-Marie Postovit是这项研究的第一作者,也是亨德里克斯实验室的博士后实习生,目前是加拿大西安大略大学的助理教授。
胚胎干细胞是多能性的,这意味着它们可以根据从微环境(周围细胞、组织和脉管系统)接收到的信号,变成成人体内200多种细胞类型中的任何一种。在癌症进展过程中,恶性细胞也从其微环境中接收和释放信号,这些信号促进肿瘤生长和转移。
亨德里克斯和他的同事们的开创性工作阐明了,通过变得更像非特化的干细胞,侵袭性黑色素瘤细胞如何获得更强的迁移、侵袭和转移能力,同时几乎不被免疫系统发现。
Hendrix和他的合作者先前证明了由hESCs调控的三维基质诱导转移性黑色素瘤细胞恢复到正常的皮肤细胞样类型,并能够以hESCs的方式形成集落(Postovit和setor等人,干细胞24:501-505,2006)。
Hendrix说:“这一观察让我们认识到hESC微环境对转移性黑色素瘤细胞重编程的强大影响。”
在随后的实验中,Hendrix、Postovit和其他研究人员发现,侵袭性黑色素瘤和乳腺癌会产生一种名为Nodal的“形态发生”蛋白,这种蛋白对人类胚胎干细胞的多能性至关重要(Topczewska et al ., Nature Medicine 12:25 -932, 2006)。其他研究人员发现Nodal也存在于睾丸癌中。
“因此,Nodal可以作为人类癌症侵袭行为的预后标记,”Hendrix说。
正如PNAS研究中所描述的那样,在正常情况下,Lefty蛋白抑制Nodal的产生,因此在胚胎细胞分化和发育中起着重要作用。
亨德里克斯和他的同事们发现,转移性肿瘤细胞不表达Lefty,这使得它们以一种不受管制的方式过量产生Nodal。
然而,当研究小组将转移性肿瘤细胞暴露于含有Lefty的hESCs微环境中时,他们发现这些癌细胞中Nodal的表达(产生)显著降低,肿瘤细胞生长和侵袭性降低,细胞凋亡或程序性细胞自杀增加。
尽管暴露在hESC微环境中可以抑制转移性黑色素瘤和乳腺癌细胞的Nodal表达和肿瘤生长,但乳腺癌细胞经历了更复杂的重编程。黑色素瘤细胞在三天内对hesc衍生因子有反应,但乳腺癌细胞需要额外两天才能达到最显著的Nodal减少。
这种差异可能是由于两种细胞类型之间信号传导机制的差异。然而,尽管黑色素瘤细胞和乳腺癌细胞之间存在内在差异,但这些不同的肿瘤类型在暴露于hESC微环境后都发生了细胞自杀。
Hendrix说:“两种肿瘤反应的显著相似性可能归因于可塑性的共性(例如,Nodal的异常和不受调节的表达),这种可塑性不分青红皂红地将高度侵袭性的癌细胞结合在一起,而不管它们的组织来源如何。”
Hendrix说:“此外,hec微环境的肿瘤抑制作用,通过中和侵袭性肿瘤细胞中Nodal的表达,为癌症治疗提供了以前未被探索的新治疗方式。”
然而,尽管研究结果表明hesc衍生的Lefty可能具有阻止转移的潜力,但它并不是胚胎微环境中唯一的肿瘤抑制因子。
该研究的观察结果强调了在hESC微环境中分离影响肿瘤细胞命运和逆转转移性肿瘤细胞(如黑色素瘤和乳腺癌)癌变特性的因素的潜在效用。