在美国食品和药物管理局(FDA)最近批准后,南佛罗里达州的转移性黑色素瘤患者很快就可以接受这种晚期皮肤癌的首个细胞疗法。这种疗法被称为肿瘤浸润淋巴细胞疗法(tumor- infiltration lymphocyte therapy,简称TIL),利用患者自身的免疫细胞来对抗癌症。迈阿密大学米勒医学院的西尔维斯特综合癌症中心是南佛罗里达州唯一提供这种治疗的中心。
根据美国疾病控制与预防中心(CDC) 2020年的一份报告,佛罗里达州是美国每年新发黑色素瘤病例数量第二高的州
此外,Sylvester的研究人员将参与TIL的制造商Iovance biotheraptics即将进行的临床试验,以确定对该疗法进行某些修改是否可以提高其对更多患者的有效性。
在FDA批准之前,对名为lifileucel的TIL疗法进行的试验显示,153名患者的反应率为32%。Lifileucel被批准用于黑色素瘤进展的患者,尽管接受了其他形式的免疫治疗,包括涉及检查点抑制剂的治疗,以及针对BRAF基因常见突变的黑色素瘤的靶向治疗。
他补充说,在导致lifileucel获批的临床试验中,超过一半对该疗法反应良好的患者在三年多的时间里保持了这种反应。
尽管TIL治疗已经在实验室和临床试验中研究了几十年,但利替鲁是FDA批准的首个TIL治疗药物。
释放免疫反应
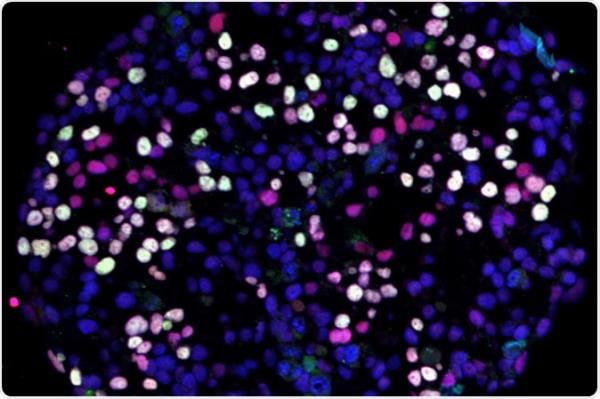
肿瘤浸润淋巴细胞是一种自然产生的免疫细胞,由白细胞、T细胞和B细胞混合而成,它们侵入肿瘤,试图与肿瘤作斗争。为了提高它们的天然抗癌能力,TIL疗法包括通过手术切除患者的肿瘤,分离其中的淋巴细胞,然后在特殊的制造设备中大量培养淋巴细胞,然后再将其重新注入患者体内。
与其他类型的细胞疗法(如CAR-T细胞疗法)不同,淋巴细胞不是通过基因工程来识别癌症的,因为它们已经适应了患者的特定肿瘤。TIL方法还包括输注后的治疗,以激活和刺激患者体内的淋巴细胞。
卢茨基说,这种疗法通常包括手术、输注前的高剂量化疗和随后的治疗,可能会对患者造成伤害,那些有心脏病或其他健康问题的患者可能无法忍受这种治疗。
“这些都不是简单的治疗方法,但许多患者确实有很好的反应,”他解释说。
即将进行的临床试验
Lutzky计划很快开始招募Sylvester参与Iovance二期试验,并希望在明年招募10名或更多患者。符合条件的参与者将是先前治疗失败的晚期黑色素瘤患者。
该试验将测试TIL疗法的一种变体,在这种疗法中,对免疫细胞进行基因工程改造,去除一种名为PD-1的基因,这种基因对免疫细胞的活性起天然阻断作用。癌细胞经常劫持这个过程来关闭身体的免疫细胞。
“从淋巴细胞中去除PD-1可能会增强它们在体内杀死癌症的能力,”Lutzky说。“实验室研究和对这些修饰细胞的早期临床试验表明,它们与未经修饰的淋巴细胞一样活跃。”
治疗突破之旅
在加入Sylvester之前,Lutzky参与了一项临床试验,该试验导致FDA批准了另一种用于转移性黑色素瘤的免疫疗法——一种名为ipilimumab的检查点抑制剂。事实上,黑色素瘤是第一个检查点抑制剂被批准用于治疗的癌症。
由于黑色素瘤的反应与免疫系统密切相关,免疫疗法对这种癌症的效果往往比其他类型的癌症更好。此外,用免疫疗法治疗黑色素瘤的经验教训使研究人员和临床医生能够将这些发现应用于治疗其他癌症,Lutzky说。
他说:“黑色素瘤是第一个发现检查点抑制剂有效的肿瘤,并建立了我们现在所说的癌症治疗的第四大支柱,在手术、化疗和放疗之外增加了免疫疗法。”“这真是一段奇妙的旅程。”