在最近发表在《实验医学杂志》上的一项研究中,研究人员通过感染人类肺组织,并使用单细胞核糖核酸测序(scRNA-seq)重建不同肺细胞类型的“感染假时间”转录程序,确定了严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)的细胞趋向性和转录组后果。
2019冠状病毒病(COVID-19)等下呼吸道感染是世界范围内的主要死亡原因,会导致肺炎和急性呼吸窘迫综合征。了解它们的早期阶段是很困难的。研究人员使用经典的组织病理学方法和单细胞多组学分析,从肺灌洗、活检或尸检材料中推断人类发病的早期阶段。这些方法以无与伦比的细胞和分子分辨率揭示了COVID-19肺炎的全面图像,暗示感染模型包括肺泡上皮、毛细血管、巨噬细胞和骨髓细胞。
一个关于这项研究
在本研究中,研究人员建立了一种实验性COVID-19模型,从细胞水平研究SARS-CoV-2在人肺原生组织中的早期分子过程和致病机制。
研究人员确定了SARS-CoV-2的细胞趋向性及其对特定类型肺细胞中宿主细胞基因表达的独特和动态影响。主要靶点是肺内巨噬细胞,其中一种SARS-CoV-2接管转录组,诱导靶向宿主干扰素(IFN)抗病毒程序,以及几种趋化因子、促纤维化、促炎和细胞因子信号传导到肺的各种结构和免疫细胞。
为了确定COVID-19在人体肺部的早期阶段,研究人员将从手术标本或器官供体个体获得的肺组织切成厚切片,并将其用于组织培养分析。随后,他们以1.0感染倍数(MOI)将组织暴露于SARS-CoV-2 USA-WA1 2020菌株中两小时,然后让SARS-CoV-2感染持续两到三天。他们对培养上清液进行了斑块试验。
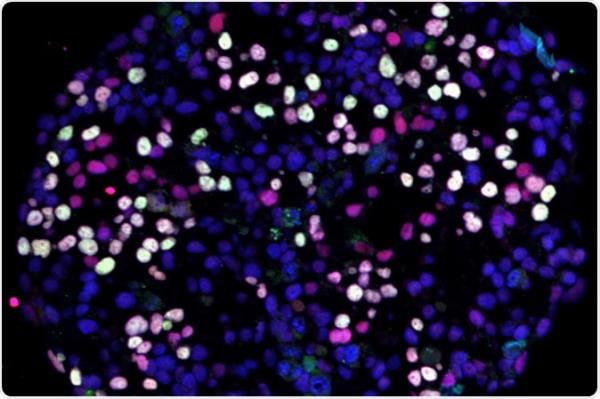
研究人员分离了这些切片,并通过scRNA-seq对它们进行了检测,以评估SARS-CoV-2感染期间宿主和病毒的基因表达。他们还通过分析西西里框架的scRNA-seq数据集,研究了病毒RNA分子的连接结构和加工过程。他们使用分子图谱标记来区分健康肺切片中的肺细胞类型,并测量感染细胞中的病毒RNA水平。
该团队进行了多重单分子荧光原位杂交(smFISH),以确认肺细胞的嗜性发现并显示感染细胞。他们使用单细胞基因表达模式来识别由SARS-CoV-2感染的a-IMs引发的炎症和促纤维化信号的细胞靶点。他们设计了一种用SARS-CoV-2刺突(S)蛋白假型慢病毒(lentii -S- nluc - tdt)纯化人肺巨噬细胞群体的技术,以研究肺巨噬细胞的进入途径。
研究人员在体外培养的人肺切片上感染了SARS-CoV-2,产量在培养24至72小时之间上升。他们通过热灭活、紫外线(UV)处理或给药10.0 μ M remdesivir(一种RNA依赖性RNA聚合酶抑制剂,用于治疗COVID-19)来预防病毒库存感染。
结果
分析表明,SARS-CoV-2优先感染活性间质巨噬细胞(IMs),其可聚集数百个SARS-CoV-2 RNA分子,占细胞转录组的60%以上,并产生致密的病毒RNA小体。感染的肺泡巨噬细胞(AMs)没有表现出严重的反应,spike (S)蛋白依赖的病毒利用血管紧张素转换酶2 (ACE2)和分化簇169 (CD169)进入AMs,并通过CD209进入IM。
他们发现,在39个末端区域之外的不寻常序列之间存在典型的亚基因组连接,表明肺培养物中产生了典型型SARS-CoV-2信使RNA (mRNA)。他们还发现了数百个新的亚基因组连接,显示了肺部感染期间产生的广泛的非规范和规范的SARS-CoV-2亚基因组rna。
新型冠状病毒在am和IMs中的发生、转变、发病机制和病毒生命周期模型(a-d) COVID-19在人肺内起始并从病毒性肺炎向致死性COVID-19 ARDS转变的模型。(a) SARS-CoV-2病毒粒子传播和到达肺泡。腔内AM遇到从上呼吸道脱落进入肺部的病毒粒子。AMs可以表达低到中等数量的病毒RNA分子,可以传播感染,但“包含”病毒RNA,使其无法接管整个转录组,并且对病毒感染仅显示非常有限的宿主细胞炎症反应。(b)复制和上皮损伤。SARS-CoV-2病毒粒子通过其典型受体ACE2进入AT2细胞,并“复制”到高病毒RNA水平,产生传染性病毒粒子并引发病毒性肺炎。(c) a-IM接管和炎症信号。SARS-CoV-2病毒粒子通过AT2细胞经上皮释放病毒粒子或损伤上皮屏障向间质空间扩散,进入a-IMs。受感染的a-IMs可以表达非常高水平的病毒RNA,这些病毒RNA支配(“接管”)宿主转录组,并可以传播感染。病毒接管触发趋化因子和细胞因子的诱导,形成炎症和纤维化信号的焦点。(d)内皮破裂和免疫浸润。a-IM炎症细胞因子IL6靶向肺泡结构细胞,导致上皮和内皮细胞破坏,炎症细胞因子从间质或血液中招募指定的免疫细胞,这些免疫细胞涌入并浸润肺泡,导致COVID-19 ARDS。局部炎症分子被循环的免疫细胞放大,并相互通过血液传播,引起细胞因子风暴的全身症状。(e) AMs和IMs中SARS-CoV-2病毒生命周期的比较。虽然两者都能产生感染性病毒粒子,但注意病毒进入受体的差异(AMs可以使用ACE2和CD169/SIGLEC1,而IMs使用CD209);病毒RNA转录的dsRNA中间体(在AMs中更大);全长基因组RNA的复制(在IMs中更多);病毒接管、RNA小体的形成、宿主细胞强烈炎症反应的诱导(仅在IMs中)和细胞破坏/死亡(仅在IMs中)。
热、UV-C灭活或瑞德西韦治疗阻止典型和非典型连接的发展。研究小组观察到,SARS-CoV-2在176,382个细胞中接管了一种活化的IM亚型,这些细胞具有从四个供体肺的感染肺切片中获得的高质量转录组,以及从模拟感染肺切片(不添加病毒培养)中获得的112,359个细胞和95,389个未培养的对照细胞(直接来自新鲜切割的肺切片)中获得的转录组。A - ims在感染假时间内的差异基因表达研究显示,宿主基因表达改变与SARS-CoV-2 RNA水平相对应。
该研究发现,COVID-19肺炎感染和接管引起对活化的间质巨噬细胞特异性的早期抗病毒细胞反应,从而产生强大的免疫和纤维化信号中心。炎性小体激活是不常见的,只有在a-IM感染晚期才能检测到。针对CD169和CD209的阻断抗体阻止进入IMs和AMs。该研究还强调IMs是最脆弱的肺靶点,最初的重点是炎症和纤维化。两种独特的巨噬细胞靶点分子谱系对SARS-CoV-2的反应不同,影响病因和治疗。